Umělá inteligence odhaluje novou příčinu Alzheimerovy choroby
Vědci z Kalifornské univerzity v San Diegu učinili převratný objev v oblasti výzkumu Alzheimerovy choroby díky využití umělé inteligence (UI). Výzkum publikovaný v prestižním vědeckém časopise Cell odhalil dosud nerozpoznanou příčinu této devastující neurodegenerativní poruchy a identifikoval potenciální terapeutickou molekulu.
Klíčový gen PHGDH a jeho nečekaná role
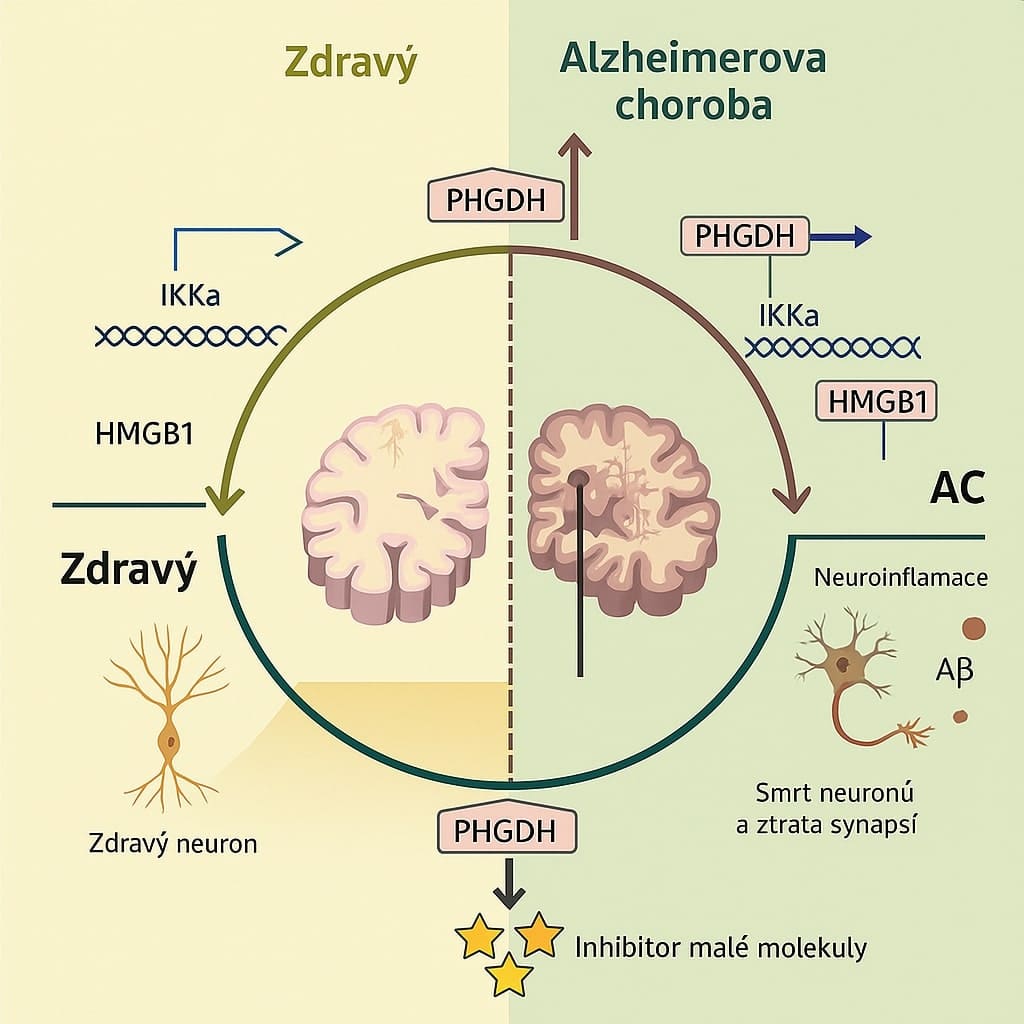
Výzkumný tým vedený profesorem Shengem Zhongem se zaměřil na gen fosfoglycerát dehydrogenázu (PHGDH), který byl dříve považován pouze za biomarker Alzheimerovy choroby. Nová studie však překvapivě prokázala, že tento gen hraje přímou kauzální roli v rozvoji onemocnění. "PHGDH byl dříve známý jen jako časný biomarker Alzheimerovy choroby, ale naše výzkumy odhalily, že zvýšené hladiny tohoto proteinu přímo urychlují patologické procesy," vysvětluje profesor Zhong. "Zjistili jsme, že vyšší exprese PHGDH koreluje s pokročilejšími stadii nemoci." Výzkumníci provedli experimenty na myších modelech a lidských mozkových organoidech, které přesvědčivě demonstrovaly, že zvyšování hladin PHGDH urychluje progres onemocnění, zatímco snižování jeho exprese vede ke zpomalení rozvoje nemoci.
Překvapivá "vedlejší funkce" odhalená umělou inteligencí
Zásadním průlomem studie bylo odhalení neočekávané "vedlejší funkce" (moonlighting function) proteinu PHGDH, která byla objevena díky strukturální analýze řízené umělou inteligencí. Vědci zjistili, že část proteinu PHGDH strukturálně napodobuje transkripční faktory – proteiny regulující genovou aktivitu. "K formulaci přesné trojrozměrné struktury a učinění tohoto objevu byla naprosto nezbytná moderní umělá inteligence," zdůraznil Zhong. "Bez těchto pokročilých nástrojů bychom tuto skrytou funkci neodhalili." Díky této neobvyklé vlastnosti se PHGDH dokáže vázat na DNA a narušovat normální genovou regulaci v astrocytech, což jsou podpůrné buňky nervové tkáně. Toto narušení zhoršuje buněčné procesy, jako je autofagie (mechanismus buněčné "recyklace"), což vede ke zvýšené akumulaci beta-amyloidních plaků – charakteristického znaku Alzheimerovy choroby.
Identifikace terapeutického kandidáta
Po odhalení tohoto mechanismu vědci použili nástroje umělé inteligence k identifikaci molekuly NCT-503, která je schopna blokovat nově objevenou funkci PHGDH vázat se na DNA, aniž by narušovala jeho primární metabolickou aktivitu. "To je klíčové, protože umožňuje cílit pouze na škodlivou 'vedlejší funkci' bez narušení důležitých metabolických procesů," vysvětluje spoluautor studie Dr. Bing Ren. V myších modelech léčených NCT-503 zaznamenali vědci významně méně amyloidních plaků a zlepšení v paměťových testech. To poskytuje nadějný důkaz koncepce pro potenciální terapeutický přístup založený na těchto zjištěních.
Převrat v pochopení sporadické Alzheimerovy choroby
Zvláště významné je, že tento objev nabízí nový mechanistický pohled na většinu případů sporadické (nezděditelné) Alzheimerovy choroby, která tvoří přibližně 95 % všech případů. "Zatímco genetické mutace zodpovědné za familiární (dědičnou) formu Alzheimerovy choroby jsou dobře prostudované, příčiny sporadické formy zůstávaly z velké části záhadou," vysvětluje další spoluautor studie Dr. Kun Zhang. "Naše zjištění poskytují nový pohled na molekulární mechanismy, které mohou být základem většiny případů Alzheimerovy choroby."
Implikace pro diagnostiku a léčbu
Tento průlom otevírá několik slibných směrů pro budoucí výzkum a vývoj léčiv:
- Včasná detekce: Monitorování hladin PHGDH by mohlo umožnit identifikaci pacientů s rizikem rozvoje Alzheimerovy choroby ještě před nástupem symptomů.
- Cílená terapie: NCT-503 nebo podobné molekuly by mohly být základem nových léčiv zaměřených na blokování "vedlejší funkce" PHGDH.
- Personalizovaná medicína: Pochopení role PHGDH může pomoci stratifikovat pacienty a přizpůsobit léčebné přístupy konkrétním molekulárním mechanismům jejich onemocnění.
"Jsme nadšeni, že jsme identifikovali tento nový mechanismus a potenciální terapeutický cíl," říká Zhong. "Naše zjištění by mohla znamenat významný posun v tom, jak přistupujeme k diagnostice a léčbě Alzheimerovy choroby."
Síla umělé inteligence v biomedicínském výzkumu
Studie zároveň demonstruje rostoucí důležitost umělé inteligence v odhalování složitých biologických mechanismů. Pokročilé algoritmy AI byly schopny analyzovat komplexní strukturální data a odhalit neobvyklou funkci proteinu, která zůstávala po léta skrytá. "Tento výzkum ukazuje, jak může umělá inteligence pomoci odhalit dosud nerozpoznané biologické mechanismy, které jsou kritické pro pochopení složitých onemocnění, jako je Alzheimerova choroba," dodává Zhong. "Je to příklad toho, jak interdisciplinární přístup kombinující biologii, medicínu a informatiku může přinést průlomové objevy."
Další výzkum
Výzkumný tým nyní plánuje další studie k hlubšímu pochopení mechanismu, kterým PHGDH přispívá k patologii Alzheimerovy choroby, a k optimalizaci potenciálních terapeutických strategií. Rovněž probíhá výzkum zaměřený na identifikaci dalších molekul, které by mohly být účinnější než NCT-503. "Jsme teprve na začátku cesty," uzavírá Zhong. "Ale věříme, že tento objev by mohl být klíčovým krokem směrem k novým, účinným terapiím pro miliony lidí trpících Alzheimerovou chorobou po celém světě."