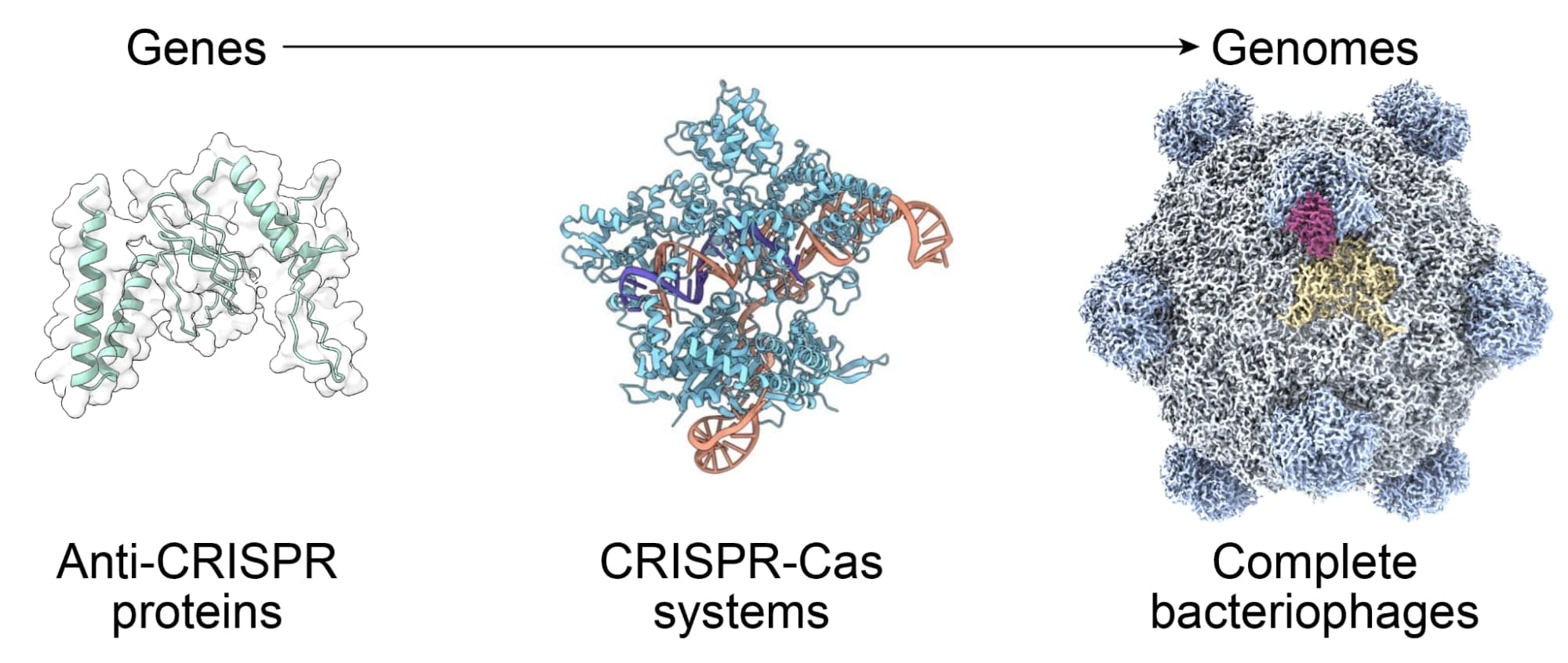
AI navrhuje viry, které ničí odolné bakterie
Vědci z Arc Institute dosáhli průlomu v oblasti umělé inteligence a biologie. Pomocí modelů Evo vytvořili první plně funkční syntetické genomy bakteriálních virů, známých jako fágy. Tyto genomy vycházejí z historického fágu ΦX174, který má 5 386 nukleotidů a kóduje 11 genů. Tento fág byl v roce 1977 prvním sekvenovaným genomem díky Fredovi Sangerovi a jeho týmu, a v roce 2003 prvním chemicky syntetizovaným genomem od Craiga Ventera. Nyní, v roce 2025, slouží jako základ pro AI-design, což představuje posun od čtení a psaní DNA k jejímu navrhování.
Výběr ΦX174 jako základu
Fág ΦX174 byl zvolen kvůli své velikosti, která je na hranici toho, co umožňují současné náklady na syntézu DNA. Jeho geny se překrývají, což komplikuje design, protože změny v jedné oblasti ovlivňují více proteinů najednou. Genom obsahuje regulační prvky a sekvence pro replikaci a balení do hostitelských buněk. Vědci, včetně Samuela Kinga a Briana Hieho, vyvinuli vlastní nástroj pro anotaci genů, který dokáže identifikovat všech 11 genů, na rozdíl od standardních metod, které jich najdou jen sedm. Tento nástroj sloužil k filtrování tisíců generovaných sekvencí, kde bylo nutné zachovat alespoň sedm proteinových shod s přirozeným ΦX174.
Ladění modelu Evo pro generování genomů
Model Evo byl původně trénován na milionech fágových genomů, ale pro tento účel ho vědci doladili na datasetu 14 466 sekvencí z rodiny Microviridae, seskupených s 99% identitou. To umožnilo generovat sekvence podobné ΦX174, ale s dostatečnou variabilitou. Vědci pečlivě upravovali vstupní podněty a parametry vzorkování, aby dosáhli rovnováhy mezi podobností a novostí. Z 302 návrhů bylo 285 chemicky syntetizováno a testováno v bakterii Escherichia coli C. Šestnáct z nich se ukázalo jako životaschopné, s mutacemi od 67 do 392 oproti nejbližším přirozeným genomům. Například Evo-Φ2147 má 392 mutací a 93% nukleotidovou identitu s fágem NC51, což ho činí kandidátem na nový druh.
Testování funkčnosti a hostitelské specifičnosti
Pro testování vyvinuli vědci metodu založenou na inhibici růstu bakterií v 96-jamkovém formátu. Syntetické genomy byly sestaveny metodou Gibsonovy asambláže a vloženy do kompetentních buněk E. coli C. Úspěšné infekce způsobily pokles optické hustoty do dvou až tří hodin. Všechny funkční fágy se omezovaly na E. coli C a příbuzný kmen E. coli W, bez růstu na šesti jiných testovaných kmenech. Některé fágy, jako Evo-Φ69, překonaly původní ΦX174 v soutěži o hostitele, kde se jejich abundance zvýšila až 65krát. Jeden fág, Evo-Φ36, začlenil protein J z vzdáleně příbuzného fága G4, což dříve selhalo při ručním inženýrství. Kryoelektronová mikroskopie odhalila, že tento kratší protein (25 aminokyselin oproti 38) zaujímá odlišnou orientaci v kapsidě.
Boj proti bakteriální rezistenci
Syntetické fágy prokázaly schopnost překonat rezistenci bakterií. Vědci vyvinuli tři rezistentní kmeny E. coli s mutacemi v operonu waa, který modifikuje povrchové receptory. Koktejly z AI-návrhů překonaly rezistenci u všech tří kmenů během jednoho až pěti průchodů, zatímco původní ΦX174 selhal. Úspěšné fágy byly mozaikové, kombinující prvky z dvou až tří návrhů, s mutacemi soustředěnými v povrchových oblastech interagujících s receptory. To podtrhuje výhodu diversity generované AI, která poskytuje více cest k adaptaci na rezistenci, což by mohlo změnit fágovou terapii z náhodného procesu na systematický.
Možnosti do budoucna
Tento přístup otevírá dveře k designu fágů pro patogeny jako Pseudomonas aeruginosa, způsobující respirační infekce, nebo Xanthomonas capestris, ničíci plodiny. Modely Evo jsou veřejně dostupné a náklady na syntézu DNA se pohybují kolem 0,07 až 0,45 dolaru za bázi. S poklesem cen a zlepšením modelů by se mohly navrhovat složitější genomy, což by umožnilo zkoumat biologické možnosti mimo přirozenou evoluci. Tento vývoj posouvá biotechnologii k novým obzorům, kde AI pomáhá řešit problémy jako multirezistentní infekce, které ročně zabíjejí stovky tisíc lidí.
Zdroj: arcinstitute.org